






Prepara tus exámenes y mejora tus resultados gracias a la gran cantidad de recursos disponibles en Docsity

Gana puntos ayudando a otros estudiantes o consíguelos activando un Plan Premium


Prepara tus exámenes
Prepara tus exámenes y mejora tus resultados gracias a la gran cantidad de recursos disponibles en Docsity
Prepara tus exámenes con los documentos que comparten otros estudiantes como tú en Docsity
Los mejores documentos en venta realizados por estudiantes que han terminado sus estudios
Estudia con lecciones y exámenes resueltos basados en los programas académicos de las mejores universidades
Responde a preguntas de exámenes reales y pon a prueba tu preparación

Consigue puntos base para descargar
Gana puntos ayudando a otros estudiantes o consíguelos activando un Plan Premium
Comunidad
Pide ayuda a la comunidad y resuelve tus dudas de estudio
Descubre las mejores universidades de tu país según los usuarios de Docsity
Ebooks gratuitos
Descarga nuestras guías gratuitas sobre técnicas de estudio, métodos para controlar la ansiedad y consejos para la tesis preparadas por los tutores de Docsity
resumen acerca de la ecuacion algunos organizadores, etcetc
Tipo: Esquemas y mapas conceptuales
1 / 13

Esta página no es visible en la vista previa
¡No te pierdas las partes importantes!








ÍNDICE (^) Introducción y Ecuación
1
(^2) ¿Y eso cómo se ve? - (Orbitales)
(^4) Números Cuánticos
(^3) Aplicaciones
(^5) Importancia e implicaciones
65 Conclusiones
ECUACIÓN DE
SCHRÖDINGER
1.¿Qué es la ecuación? La ecuación de Schrödinger es como una fórmula mágica que nos dice en qué parte del átomo es más probable encontrar a un electrón. No nos da una posición exacta, sino una zona de probabilidad. Esta zona se llama orbital.
2.¿Por qué es importante?
Antes, se pensaba que los electrones
giraban como planetas alrededor del
núcleo. Pero eso no es del todo cierto.
Schrödinger propuso una forma más
precisa: los electrones están como nubes
alrededor del núcleo, y su ecuación nos
ayuda a dibujar esa nube.
3.¿Qué obtenemos al resolverla? Al resolver esta ecuación (matemáticamente), se obtienen cuatro números cuánticos que nos dicen: En qué nivel de energía está el electrón. Qué forma tiene su nube u orbital. En qué dirección está orientado. Y si el electrón gira hacia un lado o hacia el otro (spin).
Formulación general (dependiente del tiempo)
Forma independiente del tiempo:
En su forma más simple para una partícula:
Es el operador Hamiltoniano, que representa la energía total del sistema (cinetica+pot.)
Es la función de onda, que contiene toda la información sobre el estado cuántico. Derivada parcial de psi respecto al t.
Es la constante de Planck reducida.
es el operador Laplaciano, relacionado con la segunda derivada espacial.
es la energía potencial.
es la masa de la partícula.
FÓRMULAS :
CÓMO SE COMPORTA UN ELECTRÓN Y EN QUÉ ZONA DEL ÁTOMO ES MÁS PROBABLE ENCONTRARLO. LA LETRA Ψ REPRESENTA ESA PROBABILIDAD, Y RESOLVER ESTA ECUACIÓN NOS DA LA FORMA DE LOS ORBITALES
Celdas fotovoltaicas: Basadas en el efecto fotoeléctrico Resonancia magnética nuclear (RMN) y resonancia magnética (RM): utilizan principios cuánticos para detectar señales atómicas y moleculares en tejidos.
El diseño racional de fármacos: La química cuántica permite modelar la interacción entre moléculas activas y receptores biológicos. CIENTÍFICAS
3.- APLICACIONES
TECNOLÓGICAS
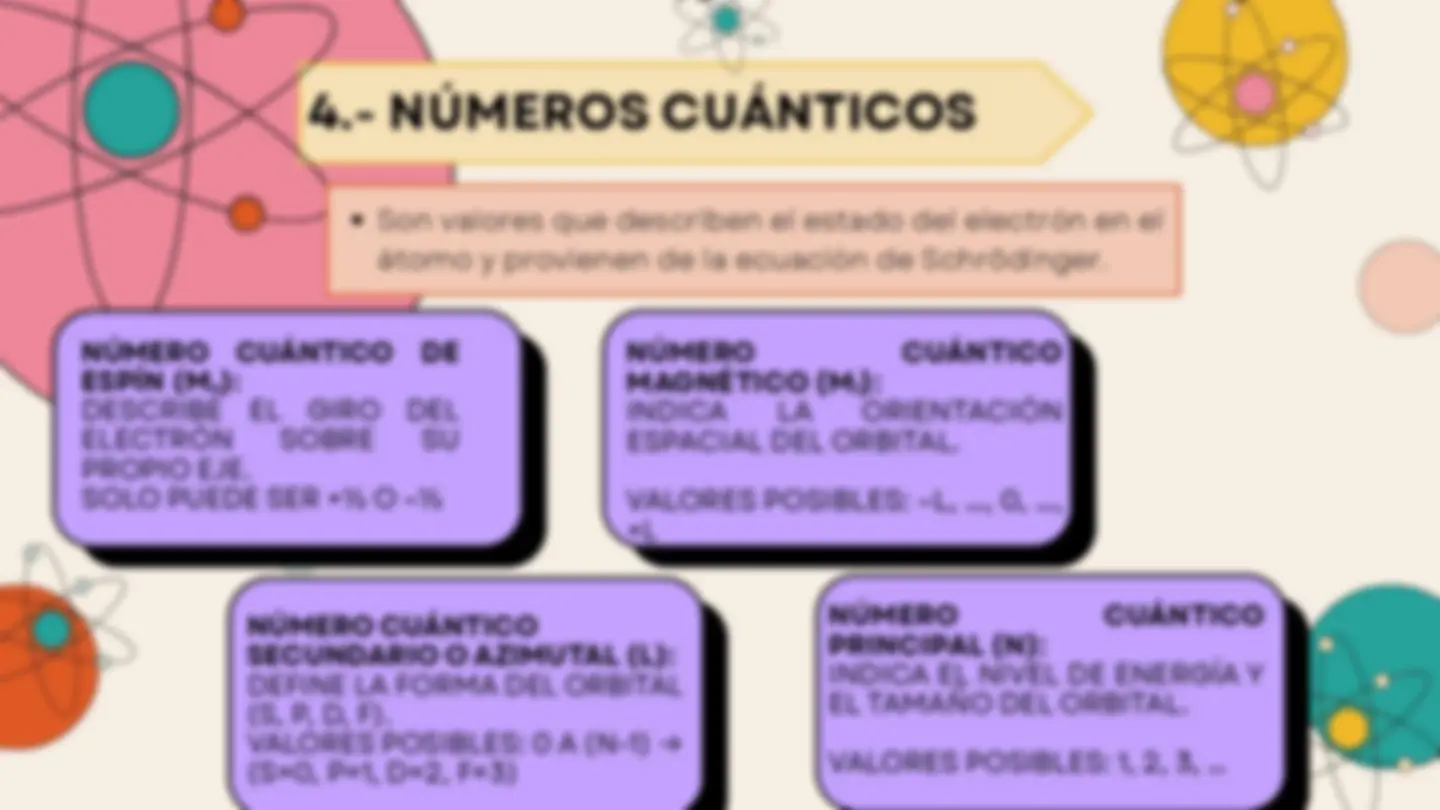
4.- NÚMEROS CUÁNTICOS
Son valores que describen el estado del electrón en el átomo y provienen de la ecuación de Schrödinger.
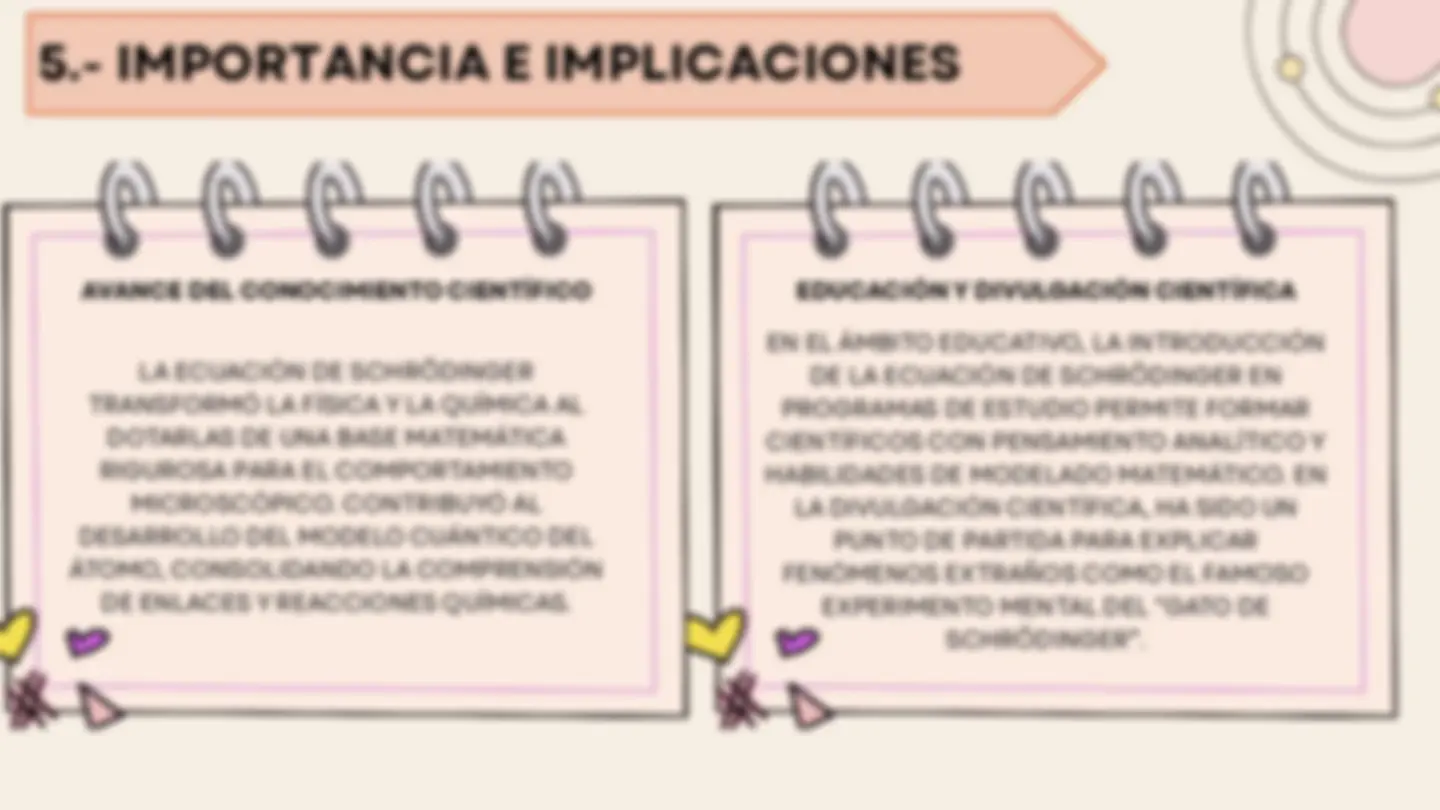
5.- IMPORTANCIA E IMPLICACIONES
AVANCE DEL CONOCIMIENTO CIENTÍFICO
LA ECUACIÓN DE SCHRÖDINGER TRANSFORMÓ LA FÍSICA Y LA QUÍMICA AL DOTARLAS DE UNA BASE MATEMÁTICA RIGUROSA PARA EL COMPORTAMIENTO MICROSCÓPICO. CONTRIBUYÓ AL DESARROLLO DEL MODELO CUÁNTICO DEL ÁTOMO, CONSOLIDANDO LA COMPRENSIÓN DE ENLACES Y REACCIONES QUÍMICAS.
EDUCACIÓN Y DIVULGACIÓN CIENTÍFICA
EN EL ÁMBITO EDUCATIVO, LA INTRODUCCIÓN DE LA ECUACIÓN DE SCHRÖDINGER EN PROGRAMAS DE ESTUDIO PERMITE FORMAR CIENTÍFICOS CON PENSAMIENTO ANALÍTICO Y HABILIDADES DE MODELADO MATEMÁTICO. EN LA DIVULGACIÓN CIENTÍFICA, HA SIDO UN PUNTO DE PARTIDA PARA EXPLICAR FENÓMENOS EXTRAÑOS COMO EL FAMOSO EXPERIMENTO MENTAL DEL “GATO DE SCHRÖDINGER”.
LA ECUACIÓN DE SCHRÖDINGER DESCRIBE CÓMO EVOLUCIONA UN SISTEMA CUÁNTICO (COMO UN ELECTRÓN O UN ÁTOMO) EN EL TIEMPO.
ESTA ECUACIÓN PERMITE QUE UN SISTEMA ESTÉ EN VARIOS ESTADOS A LA VEZ, LO QUE SE LLAMA SUPERPOSICIÓN CUÁNTICA.
GRACIAS POR
SU
ATENCIÓN