

























Prepara tus exámenes y mejora tus resultados gracias a la gran cantidad de recursos disponibles en Docsity

Gana puntos ayudando a otros estudiantes o consíguelos activando un Plan Premium


Prepara tus exámenes
Prepara tus exámenes y mejora tus resultados gracias a la gran cantidad de recursos disponibles en Docsity
Prepara tus exámenes con los documentos que comparten otros estudiantes como tú en Docsity
Los mejores documentos en venta realizados por estudiantes que han terminado sus estudios
Estudia con lecciones y exámenes resueltos basados en los programas académicos de las mejores universidades
Responde a preguntas de exámenes reales y pon a prueba tu preparación

Consigue puntos base para descargar
Gana puntos ayudando a otros estudiantes o consíguelos activando un Plan Premium
Comunidad
Pide ayuda a la comunidad y resuelve tus dudas de estudio
Descubre las mejores universidades de tu país según los usuarios de Docsity
Ebooks gratuitos
Descarga nuestras guías gratuitas sobre técnicas de estudio, métodos para controlar la ansiedad y consejos para la tesis preparadas por los tutores de Docsity
O ciclo do ácido cítrico (também conhecido como ciclo de krebs ou ciclo do ácido tricarboxílico) é uma via catabólica central e praticamente universal pela qual os compostos derivados da degradação de carboidratos, gorduras e proteínas são oxidados a co2, com a maior parte da energia da oxidação temporariamente armazenada nos transportadores de elétrons fadh2 e nadh. Durante o metabolismo aeróbio, esses elétrons são transferidos ao o2, e a energia do fluxo de elétrons é capturada na forma de atp. Detalhadamente as reações que compõem o ciclo do ácido cítrico, sua regulação e sua conexão com outras vias metabólicas, como o ciclo do glioxilato. Além disso, aborda questões relacionadas à síntese de oxaloacetato, à razão [nadh]/[nad+] e à constante de equilíbrio da última reação do ciclo.
Tipo: Apuntes
1 / 33

Esta página no es visible en la vista previa
¡No te pierdas las partes importantes!


























omo foi visto no Capítulo 14, algumas células obtêm energia (ATP) pela fermentação, degradando a glico- se na ausência de oxigênio. Para a maioria das células eucarióticas e muitas bactérias, que vivem em condições aeróbias e oxidam os combustíveis orgânicos a dióxido de carbono e água, a glicólise é apenas a primeira etapa para a oxidação completa da glicose. Em vez de ser reduzido a lactato, etanol ou algum outro produto da fermentação, o piruvato produzido pela glicólise é posteriormente oxida- do a H 2 O e CO 2. Essa fase aeróbia do catabolismo é chama- da de respiração. No sentido fisiológico ou macroscópico mais amplo, respiração alude à captação de O 2 e elimina- ção de CO 2 por organismos multicelulares. Bioquímicos e biólogos celulares, entretanto, utilizam esse termo em um sentido mais estrito para referirem-se ao processo molecu- lar por meio do qual as células consomem O 2 e produzem CO 2 – processo mais precisamente denominado respira- ção celular. A respiração celular acontece em três estágios princi- pais ( Figura 16-1 ). No primeiro, moléculas combustíveis orgânicas – glicose, ácidos graxos e alguns aminoácidos – são oxidadas para produzirem fragmentos de dois carbonos, na forma do grupo acetil da acetil-coenzima A (acetil-CoA). No segundo estágio, os grupos acetil entram no ciclo do áci- do cítrico, que os oxida enzimaticamente a CO 2 ; a energia liberada é conservada nos transportadores de elétrons re- duzidos NADH e FADH 2. No terceiro estágio da respiração, estas coenzimas reduzidas são oxidadas, doando prótons (H^1 ) e elétrons. Os elétrons são transferidos ao O 2 – o acep- tor final de elétrons – por meio de uma cadeia de moléculas transportadoras de elétrons, conhecida como cadeia res- piratória. No curso da transferência de elétrons, a grande quantidade de energia liberada é conservada na forma de ATP, por um processo chamado de fosforilação oxidativa (Capítulo 19). A respiração é mais complexa do que a glicó- lise e acredita-se que tenha evoluído muito mais tardiamen-
te, após o surgimento das cianobactérias. As atividades me- tabólicas das cianobactérias são responsáveis pelo aumento dos níveis de oxigênio na atmosfera terrestre, um momento decisivo na história evolutiva. Primeiro será abordada a conversão de piruvato a gru- pos acetil e, então, a entrada destes grupos no ciclo do ácido cítrico , também chamado de ciclo do ácido tri- carboxílico ( TCA , de tricarboxylic acid ) ou ciclo de Krebs (em homenagem ao seu descobridor, Hans Krebs). A seguir, serão examinadas as reações do ciclo e as enzimas que as catalisam. Já que os intermediários do ciclo do ácido cítrico também são desviados como precursores biossin- téticos, serão consideradas algumas maneiras pelas quais esses intermediários são repostos. O ciclo do ácido cítrico é um pivô do metabolismo, com vias catabólicas chegando e vias anabólicas partindo, sen- do cuidadosamente regulado em coordenação com outras vias. O capítulo termina com uma descrição da via do glio- xilato, uma sequência meta- bólica presente em certos or- ganismos que utiliza algumas das mesmas enzimas e reações utilizadas pelo ciclo do ácido cítrico, causando a síntese lí- quida de glicose a partir dos triacilgliceróis armazenados.
16.1 Produção de acetil-CoA (acetato ativado) Em organismos aeróbios, glicose e outros açúcares, ácidos graxos e a maioria dos aminoácidos são finalmente oxida- dos a CO 2 e H 2 O pelo ciclo do ácido cítrico e pela cadeia respiratória. Antes de entrarem no ciclo do ácido cítrico, os esqueletos de carbono dos açúcares e ácidos graxos são convertidos ao grupo acetil da acetil-CoA, a forma na qual a maioria dos combustíveis entra no ciclo. Os carbonos de muitos aminoácidos também entram no ciclo dessa manei- ra, embora alguns aminoácidos sejam convertidos a outros intermediários do ciclo. Aqui, o foco será em como o piru- vato, derivado da glicose e de outros açúcares pela glicólise,
Hans Krebs, 1900-
é oxidado a acetil-CoA e CO 2 pelo complexo da piruvato- -desidrogenase ( PDH , de pyruvate dehydrogenase ), um grupo de enzimas – múltiplas cópias de três enzimas – loca- lizado nas mitocôndrias de células eucarióticas e no citosol de bactérias. O exame cuidadoso desse complexo enzimático é gra- tificante sob diversos aspectos. O complexo da PDH é um exemplo clássico e muito estudado de um complexo mul- tienzimático no qual uma série de intermediários químicos permanece ligada às moléculas de enzima à medida que o substrato é transformado no produto final. Cinco cofatores, quatro derivados de vitaminas, participam do mecanismo da reação. A regulação desse complexo enzimático também
ilustra como uma combinação de modificações covalentes e mecanismos alostéricos resulta em um fluxo precisamen- te regulado em uma etapa metabólica. Finalmente, o com- plexo da PDH é o protótipo para dois outros importantes complexos enzimáticos: a -cetoglutarato-desidrogenase, do ciclo do ácido cítrico, e a -cetoácido-desidrogenase de ca- deia ramificada, das vias de oxidação de alguns aminoáci- dos (ver Figura 18-28). A notável similaridade na estrutura de proteínas, na exigência de cofator e nos mecanismos de reação desses três complexos inquestionavelmente reflete uma origem evolutiva comum.
O piruvato é oxidado a acetil-CoA e CO 2 A reação geral catalisada pelo complexo da piruvato-desi- drogenase é uma descarboxilação oxidativa , um pro- cesso de oxidação irreversível no qual o grupo carboxil é removido do piruvato na forma de uma molécula de CO 2 , e os dois carbonos remanescentes são convertidos ao grupo acetil da acetil-CoA ( Figura 16-2 ). O NADH formado nessa reação doa um íon hidreto ( : H^2 ) para a cadeia respiratória (Figura 16-1), que transferirá os dois elétrons ao oxigênio ou, em microrganismos anaeróbios, a um aceptor de elé- trons alternativo, como nitrato ou sulfato. A transferência de elétrons do NADH ao oxigênio gera, ao final, 2,5 molécu- las de ATP por par de elétrons. A irreversibilidade da rea- ção do complexo da PDH foi demonstrada por experimen- tos com marcação isotópica: o complexo não pode religar CO 2 radioativamente marcado à acetil-CoA para formar uma molécula de piruvato com o carboxil marcado.
O complexo da piruvato-desidrogenase requer cinco coenzimas A combinação de desidrogenação e descarboxilação do pi- ruvato ao grupo acetil da acetil-CoA (Figura 16-2) requer a ação sequencial de três enzimas diferentes e cinco coenzi- mas diferentes ou grupos prostéticos – pirofosfato de tiami- na (TPP, de thiamine pyrophosphate ), dinucleotídeo de flavina-adenina (FAD, de flavin adenine dinucleotide ), coenzima A (CoA, algumas vezes denominada CoA-SH, para enfatizar a função do grupo ¬SH), dinucleotídeo de nico- tinamida-adenina (NAD, de nicotinamide adenine dinu- cleotide ) e lipoato. Quatro vitaminas diferentes essenciais à nutrição humana são componentes vitais desse sistema: tiamina (no TPP), riboflavina (no FAD), niacina (no NAD)
Complexo da piruvato- -desidrogenase
(transportadores de e^2 reduzidos)
Cadeia respiratória (transferência de elétrons)
Estágio 3 Transferência de elétrons e fosforilação oxidativa
Ciclo do ácido cítrico
Estágio 2 Oxidação da acetil-CoA
Acetil-CoA
Oxaloacetato
Piruvato
Glicólise
Ácidos graxos
Amino- ácidos
e^2
Estágio 1 Produção de acetil-CoA
e^2
e^2
e^2
e^2
e^2
e^2
e^2
e^2
Glicose
Citrato
NADH, FADH 2
ADP + Pi ATP
H2O
CO (^2)
CO (^2)
CO 2
2H+^ + 12 O
FIGURA 161 Catabolismo de proteínas, gorduras e carboidratos durante os três estágios da respiração celular. Estágio 1: a oxidação de ácidos graxos, glicose e alguns aminoácidos gera acetil-CoA. Estágio 2: a oxidação dos grupos acetil no ciclo do ácido cítrico inclui quatro etapas nas quais os elétrons são removidos. Estágio 3: os elétrons carreados por NADH e FADH 2 convergem para uma cadeia de transportadores de elétrons mitocondrial (ou, em bactérias, ligados à membrana plasmática) – a cadeia respiratória – reduzindo, no final, O 2 a H 2 O. Este fluxo de elétrons impele a produção de ATP.
DG98 5 233,4 kJ/mol
CoA-SH 1 NADH
Acetil-CoA
O C
NAD S-CoA 1
C
Piruvato
CH 3
O
O
C
O^2
CH 3
CO 2
Complexo da piruvato-desidrogenase (E 1 1 E 2 1 E 3 )
TPP, lipoate, FAD
FIGURA 162 Reação geral catalisada pelo complexo da piruvato- -desidrogenase. As cinco enzimas participantes desta reação e as três en- zimas que formam o complexo são discutidas no texto.
16-5c). Os domínios de E 2 são separados por conectores, sequências de 20 a 30 resíduos de aminoácidos, ricos em Ala e Pro e intercalados com resíduos carregados; esses co- nectores tendem a assumir formas estendidas, mantendo os três domínios afastados. O sítio ativo de E 1 está ligado ao TPP, e o de E 3 está liga- do ao FAD. Duas proteínas de regulação também fazem par- te do complexo, uma proteína-cinase e uma fosfoproteína- -fosfatase, como discutido a seguir. Essa estrutura E 1 -E2-E básica tem sido conservada durante a evolução e é utilizada em diversas reações metabólicas similares, incluindo a oxi- dação do a -cetoglutarato no ciclo do ácido cítrico (descrita a seguir) e a oxidação dos a -cetoácidos derivados da degra- dação dos aminoácidos de cadeia ramificada valina, isoleu- cina e leucina (ver Figura 18-28). Dentro de uma determi- nada espécie, a E 3 do complexo da PDH é idêntica à E 3 dos outros dois complexos enzimáticos. A ligação do lipoato à extremidade da cadeia lateral de uma Lys em E 2 gera um braço longo e flexível que pode se estender do sítio ativo de E 1 até os sítios ativos de E 2 e E 3 , possivelmente a uma distância de 5 nm ou maior.
Na canalização do substrato, o intermediário nunca deixa a superfície da enzima A Figura 16-6 mostra esquematicamente como o com- plexo da piruvato-desidrogenase conduz as cinco reações consecutivas para a descarboxilação e desidrogenação do piruvato. A etapa ➊ é essencialmente idêntica à reação catalisada pela piruvato-descarboxilase (ver Figura 14- 15c); o C-1 do piruvato é liberado como CO 2 , e o C-2, que no piruvato está no estado de oxidação de um aldeído, é unido ao TPP como um grupo hidroxietil. A primeira etapa é a mais lenta e, consequentemente, limita a velo- cidade da reação global. Ela também é o ponto no qual o complexo da PDH confirma sua especificidade ao subs- trato. Na etapa ➋, o grupo hidroxietil é oxidado ao nível de um ácido carboxílico (acetato). Os dois elétrons re-
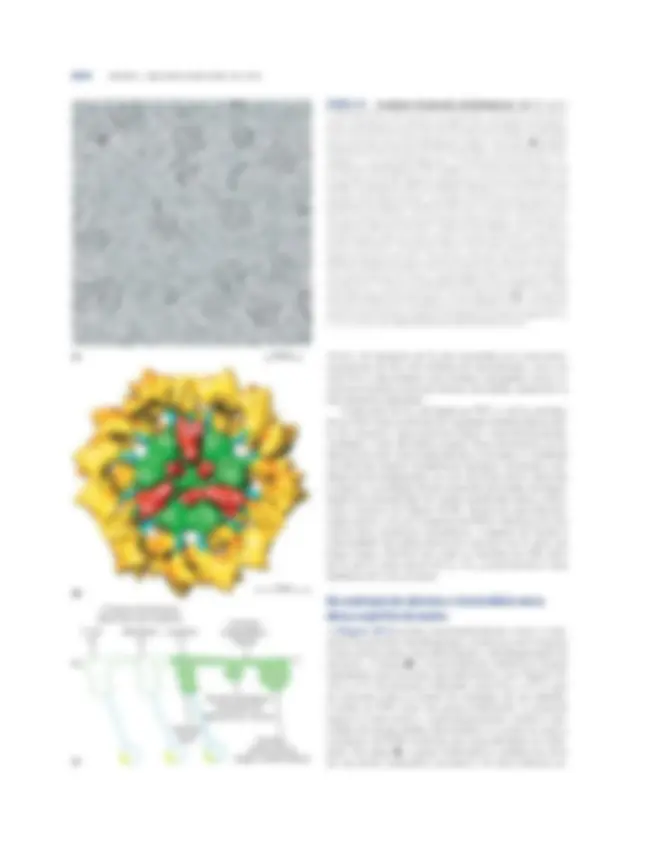
FIGURA 165 Complexo da piruvato-desidrogenase. (a) Micrografia crioeletrônica de complexos da PDH isolados de rins de bovino. Na micros- copia crioeletrônica, as amostras biológicas são visualizadas em tempera- turas extremamente baixas; isto evita os potenciais artefatos introduzidos pelos processos usuais de desidratação, fixação e coloração. (b) Imagem tridimensional do complexo da PDH, mostrando a estruturação das subu- nidades: E 1 , piruvato-desidrogenase; E 2 , di-hidrolipoil-transacetilase; e E 3 , di-hidrolipoil-desidrogenase. Esta imagem foi reconstruída pela análise de um grande número de imagens como aquelas em (a), em combinação com estudos cristalográficos das subunidades individuais. O centro (em verde) consiste em 60 moléculas de E 2 , arranjadas em 20 trímeros que formam um dodecaedro pentagonal. O domínio lipoil de E 2 (em azul) estende-se para fora para conectar-se aos sítios ativos das moléculas de E 1 (em amarelo) ar- ranjadas ao redor do centro de E 2. Algumas subunidades E 3 (em vermelho) também estão unidas ao centro, no qual um braço flexível de E 2 pode alcan- çar seus sítios ativos. Um asterisco marca o local onde um grupo lipoil está ligado ao domínio lipoil de E 2. Para tornar a estrutura mais clara, aproxima- damente metade da porção frontal do complexo foi removida. Este mode- lo foi preparado por Z.H. Zhou e colaboradores (2001); em outro modelo, proposto por J.L.S. Milne e colaboradores (2002), as subunidades de E 3 estão localizadas mais perifericamente (ver Leituras Adicionais). (c) E 2 consiste em três tipos de domínios conectados por polipeptídeos curtos: um domínio catalítico aciltransferase; um domínio de ligação, envolvido na ligação de E 2 a E 1 e E 3 ; e um ou mais (dependendo da espécie) domínios lipoil.
(a)^ 50 nm
E
E
E 3
10 nm
E (^1)
E
E 3
(b)
O número de domínios lipoil varia com a espécie. E. coli (3)
Mamíferos (2)
Levedura (1)
Domínio lipoil (^) Domínio aciltransferase (região central interna)
N C
Domínio de ligação (envolvido nas ligações E 2 -E1 e E2 -E3)
Conector polipeptídico flexível
(c)
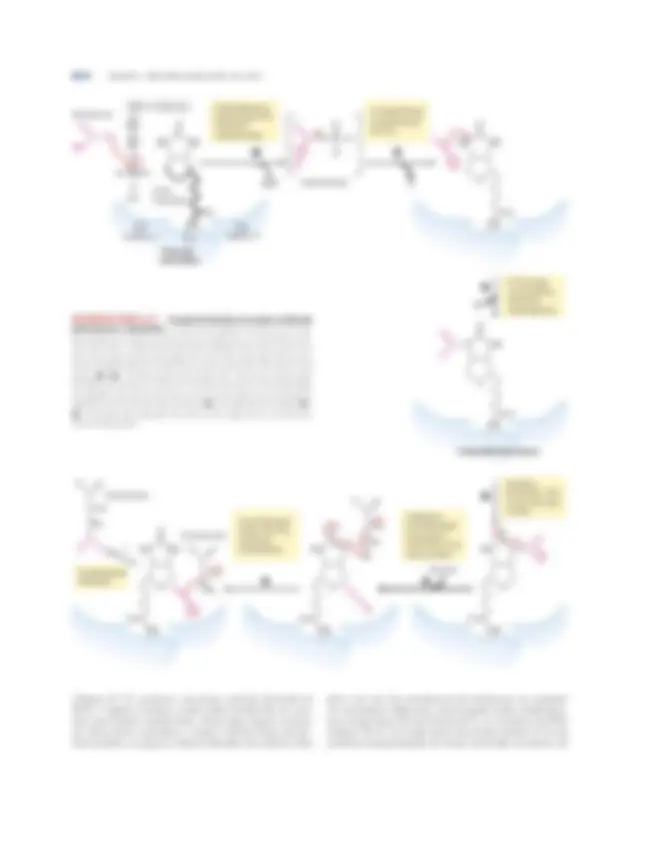
movidos nessa reação reduzem a ¬S¬S¬ de um grupo lipoil em E 2 a dois grupos tiol (¬SH). O acetil produzido nesta reação de oxidação-redução é primeiramente este- rificado a um dos grupos ¬SH do lipoil e, então, transes- terificada a CoA para formar acetil-CoA (etapa ➌). Desse modo, a energia da oxidação impele a formação de um tioéster de acetato altamente energético. As reações re- manescentes catalisadas pelo complexo da PDH (por E 3 , nas etapas ➍ e ➎) são transferências de elétrons neces- sárias para a regeneração da forma oxidada (dissulfeto) do grupo lipoil de E 2 , preparando o complexo enzimático para um novo ciclo de oxidação. Os elétrons removidos do grupo hidroxietil derivado do piruvato são passados ao NAD^1 pelo FAD. Essenciais ao mecanismo do complexo da PDH são os braços flexíveis de lipoil-lisina de E 2 , que recebem os dois elétrons e o grupo acetil de E 1 e os passam a E 3. Todas essas enzimas e coenzimas estão agrupadas, permitindo que os intermediários reajam rapidamente sem afasta- rem-se da superfície do complexo enzimático. A sequên- cia de cinco reações mostrada na Figura 16-6 é, assim, um exemplo de canalização do substrato. Os interme- diários da sequência em múltiplas etapas nunca deixam o complexo, e a concentração local do substrato de E 2 é mantida muito alta. A canalização também evita o “roubo” do grupo acetil ativado por outras enzimas que utilizam esse grupo como substrato. Como será visto, um mecanis- mo similar de aprisionamento da canalização do substrato entre sítios ativos é utilizado por algumas outras enzimas, com lipoato, biotina ou moléculas similares a CoA servin- do como cofatores. Como pode ser previsto, mutações nos genes das su- bunidades do complexo da PDH, ou uma deficiência
de tiamina na dieta, podem ter graves consequências. Animais com deficiência de tiamina são incapazes de oxi- dar o piruvato normalmente. Isso é especialmente impor- tante para o cérebro, que costuma obter toda sua energia por meio da oxidação aeróbia da glicose, em uma via que necessariamente inclui a oxidação do piruvato. O beri- -béri, doença resultante da deficiência de tiamina, carac- teriza-se pela perda da função neural. Essa doença ocorre principalmente em populações cuja dieta consiste basica- mente em arroz branco (polido), que carece da casca onde a maioria da tiamina do arroz é encontrada. Pessoas que consomem habitualmente grandes quantidades de ál- cool também podem desenvolver deficiência de tiamina, pois a maior parte da dieta ingerida consiste nas “calorias vazias”, sem vitaminas, das bebidas destiladas. Um nível de piruvato sanguíneo elevado frequentemente é um indi- cativo de defeitos na oxidação do piruvato devido a uma destas causas. ■
RESUMO 16.1 Produção de acetil-CoA (acetato ativado) c Piruvato, o produto da glicólise, é convertido a acetil- -CoA, o material de partida para o ciclo do ácido cítrico, pelo complexo da piruvato-desidrogenase. c O complexo da PDH é composto por múltiplas cópias de três enzimas: piruvato-desidrogenase, E 1 (ligada ao cofator TPP); di-hidrolipoil-transacetilase, E 2 (covalen- temente ligada ao grupo lipoil); e di-hidrolipoil-desidro- genase, E 3 (com os cofatores FAD e NAD). c E 1 catalisa a primeira descarboxilação do piruvato, pro- duzindo hidroxietil-TPP, e então a oxidação do grupo hi- droxietil a um grupo acetil. Os elétrons dessa oxidação reduzem o dissulfeto do lipoato ligado a E 2 , e o grupo
Acil- -lipoil-lisina
Lipoil-lisina oxidada
Lipoil-lisina reduzida
CoA-SH
TPP
CO (^2)
Piruvato
Hidroxietil-TPP
Piruvato- -desidrogenase, E 1
Di-hidrolipoil- -transacetilase, E 2
Di-hidrolipoil- -desidrogenase, E 3
TPP Lys
Acetil-CoA
O
O CH^3 C S-CoA CH 3 C
O
O–
C
CHOH CH
FAD
FADH
SH SH
NADH + H+
NAD +
S S
C
CH
3
S SH
O
FIGURA 166 Descarboxilação oxidativa do piruvato a acetil-CoA pelo complexo da PDH. O destino da molécula de piruvato está impresso em vermelho. Na etapa ➊, o piruvato reage com o pirofosfato de tiamina (TPP) ligado à piruvato-desidrogenase (E 1 ), sendo descarboxilado ao deriva- do hidroxietil (ver Figura 14-15). A piruvato-desidrogenase também processa a etapa ➋, a transferência de dois elétrons e do grupo acetil a partir do TPP para a forma oxidada do grupo lipoil-lisina do centro do complexo, di-hidro- lipoil-transacetilase (E 2 ), formando o acetil-tioéster do grupo lipoil reduzido. A etapa ➌ é uma transesterificação na qual o grupo ¬SH da CoA substi-
tui o grupo ¬SH de E 2 , produzindo acetil-CoA e a forma completamente reduzida (ditiol) do grupo lipoil. Na etapa ➍, a di-hidrolipoil-desidrogenase (E 3 ) promove a transferência de dois átomos de hidrogênio dos grupos lipoil reduzidos de E 2 ao grupo prostético FAD de E 3 , restaurando a forma oxidada do grupo lipoil-lisina de E 2. Na etapa ➎, o FADH 2 reduzido de E 3 transfere um íon hidreto ao NAD^1 , formando NADH. O complexo enzimático está agora pronto para outro ciclo catalítico. (As cores das subunidades correspondem àquelas na Figura 16-5b.)
ção do citrato (etapa ➊ na Figura 16-7). O grupo metil do acetato é convertido a metileno no ácido cítrico. Esse ácido tricarboxílico, então, prontamente passa por uma
série de oxidações que eliminam dois carbonos na forma de CO 2. Observe que todas as etapas levando à quebra ou à formação de ligações carbono-carbono (etapas ➊, ➌ e
Aconitase
Fumarase Aconitase
Malato-desidrogenase
Citrato-sintase
Isocitrato- -desidrogenase
Complexo a-cetoglutarato- Succinil-CoA--sintatetase -desidrogenase
Succinato-desidrogenase
Oxaloacetato
Acetil-CoA
Malato
Citrato
Isocitrato
Succinil-CoA
Succinato
Fumarato
Ciclo do ácido cítrico
a-Cetoglutarato
cis-Aconitato
O S-CoA H 2 O (^) CoA-SH
CH 2
COO^2
HO
H
C
O
CoA-SH
H 2 O
COO^2
C COO^2
CH CH 2
COO^2
C
O
CH 2 COO^2
COO^2
C COO^2
CH 2
COO^2
C
H
HO C COO^2
CH 2 COO^2
H C COO^2
CH 2 COO^2
CH 2
COO^2 COO^2
O
COO^2 CO^2
C
CH 2
CH (^2)
CH 2 COO^2
COO^2
COO^2
HC
HO
COO^2
COO^2
CH
CH 2
S-CoA CO (^2)
CoA-SH
CH 2
H 2 O
H 2 O
(3) NADH
GTP (ATP) (^) GDP (ADP) 1 P (^) i
FADH (^2)
Condensação de Claisen : grupo metil da acetil-CoA convertido a metileno no citrato.
Desidratação/reidratação : grupo —OH do citrato reposicionado no isocitrato preparando para a descar- boxilação da próxima etapa.
Fosforilação ao nível do substrato : energia do tioéster conservada na ligação fosfoanidrido do GTP ou ATP.
Desidrogenação : introdução da ligação dupla inicia a sequência de oxidação do metileno.
Hidratação : adição de água à ligação dupla introduz o grupo —OH para a próxima etapa de oxidação.
Desidrogenação : oxidação do —OH completa a sequência de oxidação; carbonil gerado posicionado para facilitar a condensação de Claisen na próxima etapa.
Descarboxilação oxidativa : mecanismo similar a piruvato-desidrogenase; dependente do carbonil no carbono adjacente.
Descarboxilação oxidativa : grupo —OH oxidado a carbonil, o que, por sua vez, facilita a descarboxilação por meio da estabilização do carbânion formado no carbono adjacente.
Reidratação
FIGURA 167 Reações do ciclo do ácido cítrico. Os átomos de carbono sombreados em cor salmão são aqueles derivados do acetato da acetil-CoA durante a primeira rodada do ciclo; estes não são os carbonos liberados na forma de CO 2 durante a primeira rodada. Observe que, no succinato e no fumarato, o grupo de dois carbonos derivado do acetato não pode mais ser especificamente indicado; como succinato e fumarato são moléculas simé- tricas, C-1 e C-2 são indistinguíveis de C-4 e C-3. O número ao lado de cada
etapa de reação corresponde a um tópico numerado nas p. 640-647. As setas em vermelho mostram onde a energia é conservada pela transferência de elétrons ao FAD ou NAD^1 , formando FADH 2 ou NADH 1 H^1. As etapas ➊, ➌ e ➍ são essencialmente irreversíveis na célula; todas as outras etapas são reversíveis. O nucleosídeo trifosfatado produzido na etapa ➎ pode ser tanto ATP quanto GTP, dependendo da isoenzima de succinil-CoA-sintetase que está catalisando a reação.
➍) dependem de grupos carbonil apropriadamente posi- cionados. Como em todas as rotas metabólicas, existe uma lógica química na sequência das etapas do ciclo do ácido cítrico: cada etapa envolve ou uma oxidação que conserve energia ou ela é um prelúdio necessário para a oxidação, colocando grupos funcionais em posições que facilitem a oxidação ou a descarboxilação oxidativa. À medida que for aprendendo as etapas do ciclo, relembre o raciocínio quí- mico para cada uma; isso tornará o processo mais fácil de entender e lembrar.
O ciclo do ácido cítrico tem oito etapas
No exame das oito etapas de reação consecutivas do ciclo do ácido cítrico, será dada especial ênfase nas transforma- ções químicas que ocorrem à medida que o citrato formado a partir de acetil-CoA e oxaloacetato é oxidado produzindo CO 2 e em como a energia dessa oxidação é conservada nas coenzimas reduzidas NADH e FADH 2.
➊ Formação do citrato. A primeira reação do ciclo é a con- densação de acetil-CoA e oxaloacetato para a formação do citrato , catalisada pela citrato-sintase :
DG98 5 232,2 kJ/mol
Citrato-sintase
S-CoA
1
CoA-SH
COO^2
O C COO^2
H 2 O
CH 2
Acetil-CoA
CH 3 C
O
Oxaloacetato
Citrato
HO COO^2
C COO^2 CH 2
O^2
O CH 2 C
Nessa reação, o carbono do metil do grupo acetil é uni- do ao grupo carbonil (C-2) do oxaloacetato. Citroil-CoA é o intermediário transitoriamente formado no sítio ativo da enzima (ver Figura 16-9). Esse intermediário é rapida- mente hidrolisado em CoA livre e citrato, que são libera- dos do sítio ativo. A hidrólise desse intermediário tioéster de alta energia torna a reação direta altamente exergôni- ca. A grande e negativa variação de energia livre padrão da reação da citrato-sintase é fundamental para o funciona- mento do ciclo, pois, como mencionado anteriormente, a concentração de oxaloacetato normalmente é muito baixa. A CoA liberada nessa reação é reciclada para participar da descarboxilação oxidativa de outra molécula de piruvato pelo complexo PDH. A citrato-sintase mitocondrial foi cristalizada e analisa- da por difração de raios X na presença e na ausência de substratos e inibidores ( Figura 16-8 ). Cada subunidade dos homodímeros da enzima é um único polipeptídeo com dois domínios, um deles grande e rígido, e o outro menor e mais flexível, com o sítio ativo entre eles. Oxaloacetato, o primeiro substrato a se ligar à enzima, induz uma grande alteração conformacional no domínio flexível, criando um
sítio de ligação para o segundo substrato, acetil-CoA. Quan- do o citroil-CoA é formado no sítio ativo da enzima, outra alteração conformacional causa a hidrólise do tioéster, libe- rando CoA-SH. Esse encaixe induzido da enzima, primeiro ao substrato e posteriormente ao intermediário da reação, diminui a probabilidade de que a clivagem da ligação tioés- ter da acetil-CoA seja prematura e improdutiva. Os estudos cinéticos da enzima são consistentes com este mecanismo bissubstrato ordenado (ver Figura 6-13). A reação catalisa- da pela citrato-sintase é fundamentalmente uma conden- sação de Claisen (p. 513), envolvendo um tioéster e uma cetona (oxaloacetato) ( Figura 16-9 ).
Análogo da acetil-CoA
Análogo da acetil-CoA
Oxaloacetato
Oxaloacetato
(a)
(b)
FIGURA 168 Estrutura da citrato-sintase. O domínio flexível de cada subunidade passa por uma alteração conformacional após a ligação ao oxa- loacetato, criando um sítio de ligação para a acetil-CoA. (a) Forma aberta da enzima isolada (PDB ID, 5CSC); (b) forma fechada ligada ao oxaloacetato e a um análogo estável da acetil-CoA (carboximetil-CoA) (derivada de PDB ID 5CTS). Nestas representações, uma subunidade está colorida em bege e a outra em verde.
A máxima “um gene-uma enzima”, formulada por George Beadle e Edward Tatum em 1940 (ver Capítulo 24), seguiu incontestada durante grande parte do século XX, assim como ocorreu com a hipótese associada de que cada pro- teína possui apenas uma função. Recentemente, porém, muitas exceções admiráveis a essa simples fórmula foram descobertas – situações nas quais uma única proteína codi- ficada por um único gene é claramente “ moonlighting ” , cumprindo mais de uma função dentro da célula. A aconi- tase é uma dessas proteínas: ela atua tanto como enzima quanto como regulador da síntese proteica. As células eucarióticas têm duas isoenzimas da aco- nitase. A isoenzima mitocondrial converte citrato a iso- citrato no ciclo do ácido cítrico. A isoenzima citosólica possui duas funções. Ela catalisa a conversão de citrato a isocitrato, fornecendo o substrato para uma isocitrato- -desidrogenase citosólica que produz NADPH com poder redutor para a síntese de ácidos graxos e outros proces- sos anabólicos no citosol. Também tem uma função na homeostase celular do ferro. Todas as células devem obter o ferro para a atividade das muitas proteínas que o requerem como cofator. Em humanos, a deficiência grave de ferro resulta em anemia, em suprimento insuficiente de eritrócitos e em uma redu- ção da capacidade transportadora de oxigênio que podem ser fatais. O excesso de ferro também é prejudicial: ele se deposita e danifica o fígado na hemocromatose e em outras doenças. O ferro ingerido na dieta é transportado na corrente sanguínea pela proteína transferrina e entra nas células por meio da endocitose mediada pelo recep- tor de transferrina. Uma vez dentro da célula, o ferro é utilizado na síntese de hemes, citocromos, proteínas Fe-S e outras proteínas dependentes de Fe, e o excesso de fer-
ro é armazenado em ligação com a proteína ferritina. Os níveis de tranferrina, receptor de transferrina, e ferritina são, portanto, cruciais para a homeostase celular de ferro. A síntese dessas três proteínas é regulada em resposta à disponibilidade de ferro – e a aconitase, em uma de suas funções, desempenha uma função-chave na regulação. A aconitase tem um agrupamento Fe-S essencial no sítio ativo (ver Figura 16-10). Quando uma célula é exau- rida de ferro, esse agrupamento Fe-S é desmantelado e a enzima perde sua atividade como aconitase. Entretanto, a apoenzima (apoaconitase, carecendo do agrupamento Fe- S) assim formada adquire agora sua segunda atividade – a capacidade de ligar-se a sequências específicas nos mRNA do receptor de transferrina e da ferritina, regulando dessa maneira a síntese proteica ao nível da tradução. Duas pro- teínas reguladoras de ferro , IRP1 e IRP2 (IRP de iron regulation protein ), foram descobertas independente- mente como reguladoras do metabolismo do ferro. Como provado posteriormente, IRP1 é idêntica à apoaconitase citosólica, e IRP2 é muito semelhante a IRP1 em estrutu- ra e função, porém, ao contrário de IRP1, IRP2 não pode ser convertida à aconitase enzimaticamente ativa. Ambas IRP1 e IRP2 se ligam a regiões nos mRNA que codificam a ferritina e o receptor de transferrina, com consequên- cias sobre a mobilização e a captação de ferro. Essas se- quências no mRNA fazem parte de estruturas em grampo (p. 292) chamadas de elementos de resposta a ferro ( IRE , de iron response elements ), localizadas nas extre-
QUADRO 161 Enzimas com mais de uma função
AAA(A)n
[ferro] baixa [ferro] alta
A IRP está ligada ao elemento de resposta a ferro (IRE)? mRNA da ferritina
IRE
IREs
59 39
Sim
Reprimida Diminuída
Ativada Aumentada
Tradução do mRNA da ferritina Síntese de ferritina
Aumentada Aumentada
Diminuída Diminuída
Estabilidade do mRNA do TfR Síntese de TfR
IRP
IRP
Aconitase
AAA(A)n
mRNA do receptor de transferrina (TfR) 59 39
Não
FIGURA Q1 O efeito de IRP1 e IRP2 sobre os mRNA da ferritina e do receptor de trans- ferrina.
FIGURA 1610 Centro de ferro-enxofre da aconitase. O centro de ferro-enxofre está em vermelho, e a molécula de citrato está em azul. Três resíduos de Cys da enzima ligam três átomos de ferro; o quarto ferro está ligado a um dos grupos carboxil do citrato e também interage não cova- lentemente com um grupo hidroxil do citrato (ligação descontínua). Um resíduo básico ( : B) na enzima auxilia no posicionamento do citrato no sítio ativo. O centro de ferro-enxofre atua na ligação do substrato e na catálise. As propriedades gerais das proteínas ferro-enxofre estão discutidas no Ca- pítulo 19 (ver Figura 19-5).
S Fe
O
H
O H (^) C
CH 2
COO^2
(^2) OOC
C C
H O O
H
H
S
Fe
Fe
S
Fe S
Citrato
S
S Cys
Cys S
Cys
::B
midades 3 9 e 5 9 dos mRNA (Figura Q-1). Quando ligadas à sequência IRE da região 5 9 não traduzida do mRNA da ferritina, as IRP bloqueiam a síntese de ferritina; quando ligadas às sequências IRE da região 3 9 não traduzida do mRNA do receptor de transferrina, as IRP estabilizam o mRNA, impedindo sua degradação e possibilitando a sín- tese de mais cópias da proteína receptora por molécula de mRNA. Assim, em células com deficiência de ferro, a cap- tação de ferro torna-se mais eficiente e o armazenamento de ferro (ligado à ferritina) é reduzido. Quando a concen- tração celular de ferro retorna aos níveis normais, IRP1 é convertida a aconitase, e IRP2 é degradada por proteólise, encerrando a resposta aos baixos níveis de ferro. A aconitase enzimaticamente ativa e a apoaconitase com atividade reguladora (na segunda jornada da pro- teína) apresentam estruturas diferentes. Como aconitase ativa, a proteína tem dois lóbulos que se fecham ao re- dor do agrupamento Fe-S; como IRP1, os dois lóbulos se abrem, expondo o sítio de ligação ao mRNA (Figura Q-2). A aconitase é apenas uma de uma lista crescente de enzimas conhecidas (ou presumidas) por realizarem uma segunda função. Muitas das enzimas glicolíticas estão incluídas nesse grupo. A piruvato-cinase atua no núcleo para regular a transcrição de genes responsivos ao hor- mônio da tireoide. A gliceraldeído-3-fosfato-desidroge- nase atua tanto como uracila-DNA-glicosilase, afetando o reparo de DNA danificado, quanto como regulador da transcrição da histona H2B. O cristalino dos olhos dos vertebrados apresenta algumas enzimas glicolíticas mul- tifuncionais, incluindo a fosfoglicerato-cinase, triose-fos- fato-isomerase e lactato-desidrogenase. Até recentemente, a descoberta de que uma proteína tem mais de uma função era principalmente uma ques- tão de sorte: dois grupos de pesquisadores estudando duas questões não relacionadas descobriam que “suas” proteínas tinham propriedades similares, as comparavam cuidadosamente e descobriam que elas eram idênticas. Com o crescimento das bases de dados com sequências de DNA e de proteínas anotadas, os pesquisadores ago- ra podem investigar deliberadamente a multifuncionali- dade das proteínas, procurando nas bases de dados por qualquer outra proteína com a mesma sequência que a proteína sob estudo, porém com função diferente. Isso
também significa que uma proteína anotada nas bases de dados como exercendo uma determinada função não necessariamente tenha apenas aquela função. O conhe- cimento de proteínas com mais de uma função também pode explicar alguns resultados intrigantes: experimen- tos nos quais uma proteína com uma função conhecida é inativada por uma mutação, mas os organismos mutantes resultantes apresentam um fenótipo sem uma relação ób- via com aquela função.
(a)
(b)
Fe-S
RNA
FIGURA Q2 As duas formas da aconitase/IRP1 citosólica com duas fun- ções distintas. (a) Na aconitase, os dois lóbulos principais estão fechados e o agrupamento Fe-S está completamente coberto; a proteína está re- presentada de forma transparente para exibir o agrupamento Fe-S (PDB ID 2B3Y). (b) Na IRP1, os lóbulos se abrem, expondo um sítio de ligação à estrutura em grampo do mRNA do substrato (PDB ID 2IPY).
COO^2 CH (^2) H H
C (^) C HO
Isocitrato
O isocitrato é oxidado pela transferência do hidreto ao NAD^1 ou NADP^1 (dependendo da isoenzima da isocitrato- -desidrogenase).
A descarboxilação é facilitada pela re- moção dos elétrons pelo carbonil adjacente e pelo Mn 21 coordenado.
O rearranjo do intermediário enol gera a-cetoglutarato.
Oxalosuccinato a-Cetoglutarato
NAD(P)^1 NAD(P)H 1 H^1 H^1 Isocitrato- -desidrogenase
Mn 21
C
O^2
C
O
O O^2
COO^2 CH (^2) CO 2 H O
C (^) C C
O^2
C
O
O O^2
COO^2 CH (^2) H O
C (^) H C C O O^2
Mn^21
COO^2 CH (^2) H C C O^2 C O O^2
MECANISMOFIGURA 1611 Isocitrato-desidrogenase. Nesta reação, o substrato, isocitrato, perde um carbono por descarboxilação oxidativa. Ver Fi-
gura 14-14 para mais informações sobre reações de transferência de hidretos envolvendo NAD^1 e NADP^1.
DG98 5 22,9 kJ/mol
S-CoA CH 2 COO^2
C O
CH 2 CH 2
COO^2
Succinil-CoA
CH 2
COO^2
Succinato
Succinil-CoA-sintetase
GDP 1 Pi GTP CoA-SH
A enzima que catalisa essa reação reversível é chamada de succinil-CoA-sintetase ou succinato-tiocinase ; ambos os nomes indicam a participação de um nucleosídeo trifos- fatado na reação (Quadro 16-2). Essa reação que poupa energia envolve uma etapa intermediária, na qual a própria molécula da enzima é fosforilada em um resíduo de His no sítio ativo ( Figura 16-13a ). Esse grupo fosfato, que tem alto potencial de transferência de grupo, é transferido ao ADP (ou GDP) para a formação de ATP (ou GTP). As células animais têm duas isoenzimas da succinil-CoA-sintetase, uma específi- ca para ADP e outra para GDP. A enzima contém duas subunidades, a ( M r 32.000), que tem o resíduo de -His (His 246 ) e o sítio de ligação para CoA, e b ( M r 42.000), que confere a especificidade por ADP ou GDP. O sítio ativo se situa na interface entre as subunidades. A estrutura do cristal da succinil-CoA-sintetase revela duas “hélices elé- tricas” (uma em cada subunidade), orientadas de maneira que seus dipolos elétricos posicionem as cargas parciais positivas próximas ao resíduo His- carregado negati- vamente (Figura 16-13b), estabilizando o intermediário fosfoenzima. (Relembre a função similar das hélices bi- polares na estabilização dos íons K^1 no canal de K^1 ; ver Figura 11-47.) A formação de ATP (ou GTP) à custa da energia libe- rada pela descarboxilação oxidativa do a -cetoglutarato é uma fosforilação ao nível do substrato, como a síntese de ATP nas reações glicolíticas catalisadas por gliceraldeído-3- -fosfato-desidrogenase e piruvato-cinase (ver Figura 14-2). O GTP formado pela succinil-CoA-sintetase pode doar o grupo fosfato terminal ao ADP para formar ATP, em uma reação reversível catalisada pela nucleosídeo-difosfato- -cinase (p. 526):
GTP 1 ADP ∆ GDP 1 ATP D G 9 o^5 0 kJ/mol
Desse modo, o resultado líquido da atividade de cada isoen- zima da succinil-CoA-sintetase é a conservação de energia como ATP. Não há variação de energia livre na reação da nucleosídeo-difosfato-cinase; ATP e GTP são energetica- mente equivalentes.
FIGURA 1613 A reação da succinil-CoA-sintetase. (a) Na etapa ➊, a CoA da succinil-CoA ligada à enzima é substituída por um grupo fosfato, for- mando um acil-fosfato de alta energia. Na etapa ➋, o succinil-fosfato doa o grupo fosfato para um resíduo de His da enzima, originando uma fosfo- -histidil-enzima de alta energia. Na etapa ➌, o grupo fosfato é transferido do resíduo de His ao fosfato terminal do GDP (ou ADP), formando GTP (ou ATP). (b) Sítio ativo da succinil-CoA-sintetase de E. coli (derivado da estrutura de PDB ID 1SCU). O sítio ativo inclui parte de ambas as subunidades, a (em azul) e b (em marrom). As hélices carregadas (azul, marrom) posicionam as cargas parciais positivas do dipolo da hélice próximas ao grupo fosfato de -His^246 na cadeia a , estabilizando a enzima com a fosfo-histidina. As enzimas de mamíferos e bactérias apresentam sequências de aminoácidos e estrutu- ras tridimensionais similares.
P Pi
Succinil-CoA-sintetase
P
Coenzima A
Hélice elétrica da subunidade b
Subunidade b
Subunidade a
Grupo fosfato
Hélice elétrica da subunidade a
P –His^246
Succinil-CoA
Succinato
Fosfo-histidil-enzima
(b)
CH (^2)
O
C S-CoA
CH (^2)
C
O O^2
CH 2
O C CH 2 C
O
(^2) O O 2
CoA-SH
GDP
GTP
Enzima ligada ao succinil-fosfato
CH 2 His
His
His
O O^2 C
CH (^2)
O
C O
(a)
➏ Oxidação do succinato a fumarato. O succinato formado a partir da succinil-CoA é oxidado a fumarato pela flavopro- teína succinato-desidrogenase :
DG98 5 0 kJ/mol
COO^2 Succinato
Succinato-desidrogenase
FAD H (^2)
Fumarato
H 2 C 2 H H 2 C 2 H
COO^2 FAD
(^2) OOC
COO^2 C C H
H
Em eucariotos, a succinato-desidrogenase está firme- mente ligada à membrana mitocondrial interna; em bac-
térias, está ligada à membrana plasmática. A enzima con- tém três grupos ferro-enxofre diferentes e uma molécula de FAD covalentemente ligada (ver Figura 19-10). Os elétrons do succinato passam pelo FAD e pelos centros de ferro-enxofre antes de entrarem na cadeia de trans- portadores de elétrons da membrana mitocondrial inter- na (da membrana plasmática em bactérias). O fluxo dos elétrons do succinato ao longo desses transportadores até o aceptor de elétrons final, O 2 , é acoplado à síntese de aproximadamente 1,5 molécula de ATP por par de elé- trons (fosforilação acoplada à respiração). Malonato, aná- logo do succinato normalmente ausente nas células, é um forte inibidor competitivo da succinato-desidrogenase, e sua adição à mitocôndria bloqueia a atividade do ciclo do ácido cítrico.
QUADRO 162 Sintases e sintetases; ligases e liases; cinases, fosfatases e fosforilases: sim, os nomes são confusos!
A citrato-sintase é uma das muitas enzimas que catalisam reações de condensação, que geram um produto quimi- camente mais complexo do que os precursores. Sinta- ses catalisam reações de condensação nas quais nenhum nucleosídeo trifosfatado (ATP, GTP e assim por diante) é necessário como fonte de energia. Sintetases catalisam reações de condensação que de fato utilizam ATP ou ou- tro nucleosídeo trifosfatado como uma fonte de energia para a reação sintética. A succinil-CoA-sintetase é uma destas enzimas. Ligases (do latim ligare , “amarrar”) são enzimas que catalisam reações de condensação nas quais dois átomos são unidos, utilizando ATP ou outra fonte de energia. (Portanto, sintetases são ligases.) A DNA-ligase, por exemplo, conserta quebras em moléculas de DNA, utilizando energia suprida por ATP ou NAD^1 ; essa enzi- ma é largamente utilizada na engenharia genética para unir pedaços de DNA. Ligases não devem ser confundi- das com liases , enzimas que catalisam clivagens (ou, na reação inversa, adições), nas quais ocorrem rearranjos eletrônicos. O complexo da PDH, que remove o CO 2 da molécula de piruvato em uma reação de oxidação, é um membro da ampla classe das liases. O nome cinase é aplicado a enzimas que transferem um grupo fosfato de um nucleosídeo trifosfatado, como o ATP, para uma molécula aceptora – um açúcar (como a hexocinase e a glicocinase), uma proteína (como a glico- gênio-fosforilase-cinase), outro nucleotídeo (como a nu- cleosídeo-difosfato-cinase) ou um intermediário metabó- lico, como o oxaloacetato (como a PEP-carboxicinase). A reação catalisada por uma cinase é uma fosforilação. Por outro lado, a fosforólise é uma reação de substituição, na qual o fosfato inorgânico ataca uma ligação química e é covalentemente ligado à molécula no ponto de quebra da ligação. Tais reações são catalisadas por fosforilases. A glicogênio-fosforilase, por exemplo, catalisa a fosforólise do glicogênio, produzindo glicose-1-fosfato. A desfosfo- rilação , remoção de um grupo fosfato a partir de um és- ter de fosfato, é catalisada por fosfatases , que utilizam
a água como espécie atacante. A frutose-bifosfatase- converte frutose-1,6-bifosfato a frutose-6-fosfato na gli- coneogênese, e a fosforilase- a -fosfatase retira os grupos fosfato dos resíduos de fosfosserina na glicogênio-fosfori- lase fosforilada. Ufa! Infelizmente, essas descrições dos tipos de enzimas se sobrepõem, e muitas enzimas são comumente chama- das por dois ou mais nomes. A succinil-CoA-sintetase, por exemplo, também é chamada de succinato-tiocinase; a enzima é uma sintetase no ciclo do ácido cítrico e uma cinase quando age no sentido da síntese de succinil-CoA. Isso expõe outra fonte de confusão na nomenclatura de enzimas. Uma enzima pode ter sido descoberta com a utilização de um experimento no qual, por exemplo, A é convertido em B. A enzima é, então, chamada de acordo com essa reação. Trabalhos posteriores, entretanto, po- dem mostrar que, na célula, a enzima funciona principal- mente convertendo B a A. Geralmente, o primeiro nome continua a ser utilizado, embora a função metabólica da enzima fosse mais bem descrita nomeando-a pela reação inversa. A enzima glicolítica piruvato-cinase ilustra esta situação (p. 554). Para um principiante na bioquímica, essa duplicação da nomenclatura pode ser desorientado- ra. Comissões internacionais têm feito esforços heroicos para sistematizar a nomenclatura das enzimas (ver Tabe- la 6-3 para um breve resumo do sistema), porém alguns nomes sistemáticos são muito longos e complicados e não são utilizados no dia a dia bioquímico. Ao longo deste livro, tentou-se utilizar os nomes en- zimáticos mais comumente utilizados pelos bioquímicos e chamar a atenção para os casos nos quais uma enzima tem mais de um nome amplamente utilizado. Para infor- mações atualizadas sobre a nomenclatura enzimática, re- corra às recomendações da Comissão de Nomenclatura da União Internacional de Bioquímica e Biologia Molecu- lar (Nomenclature Committee of the International Union of Biochemistry and Molecular Biology; www.chem.qmw. ac.uk/iubmb/nomenclature/).
QUADRO 163 Citrato: molécula simétrica que reage assimetricamente
Quando os compostos enriquecidos no isótopo de carbo- no pesado 13 C e nos isótopos de carbono radioativos 11 C e 14 C se tornaram disponíveis cerca de 60 anos atrás, eles foram imediatamente utilizados para definir o rumo dos átomos de carbono durante o ciclo do ácido cítrico. Um desses experimentos desencadeou a controvérsia sobre a função do citrato. Acetato marcado no grupo carboxil (designado [1- 14 C]acetato) foi incubado sob condições aeróbias com uma preparação de tecido animal. O aceta- to é enzimaticamente convertido a acetil-CoA nos tecidos animais, e a via do carbono do carboxil marcado, agora presente no grupo acetil, poderia assim ser determinada durante o ciclo de reações. a -Cetoglutarato foi isolado do tecido após a incubação, sendo então degradado quimi- camente por meio de reações químicas conhecidas para estabelecer a(s) posição(ões) do carbono isotópico. Esperava-se que a condensação de oxaloacetato não marcado com acetato marcado no carboxil produzisse ci- trato marcado em um dos dois grupos carboxil primários. O citrato é uma molécula simétrica, seus dois grupos car- boxil terminais são indistinguíveis. Consequentemente, era esperado que metade das moléculas de citrato marcadas originasse a -cetoglutarato marcado no grupo carboxil a e que a outra metade originasse a -cetoglutarato marcado no grupo carboxil g : isto é, esperava-se que o a -cetoglutarato
isolado fosse uma mistura dos dois tipos de moléculas mar- cadas (Figura Q-1, vias ➊ e ➋). Contrariando essas expec- tativas, o a -cetoglutarato marcado isolado da suspensão de tecido continha 14 C somente no grupo carboxil g (Figura Q-1, via ➊). Os investigadores concluíram que o citrato (ou qualquer outra molécula simétrica) não poderia ser um in- termediário da via entre acetato e a -cetoglutarato. Em vez disso, um ácido tricarboxílico assimétrico, presumivelmen- te cis -aconitato ou isocitrato, deveria ser o primeiro pro- duto formado pela condensação de acetato e oxaloacetato. Em 1948, entretanto, Alexandre Ogston mostrou que, embora o citrato não tenha centro quiral (ver Figura 1-20), ele tem potencial para reagir assimetricamente se a enzima com a qual ele interage possuir um sítio ati- vo assimétrico. Ele sugeriu que o sítio ativo da aconitase tinha três pontos aos quais o citrato deveria estar liga- do e que o citrato deveria posicionar-se de maneira a se unir especificamente a esses três pontos. Como visto na Figura Q-2, a ligação do citrato aos três pontos poderia ocorrer de uma maneira apenas, e isso acarretaria na for- mação de um único tipo de a -cetoglutarato marcado. Mo- léculas orgânicas como o citrato, sem centro quiral, mas potencialmente capazes de reagirem assimetricamente com um sítio ativo assimétrico, são atualmente chamadas de moléculas pró-quirais.
CH 3 14 COO^2
C CH 2
O COO^2
COO^2
CH 2 14 COO^2 C CH (^2)
HO COO^2
COO^2
CH 2 14 COO^2 CH HO
COO^2 CH COO^2
CH 14 COO^2
CH HO
COO^2 COO^2
1
Acetato marcado
Oxaloacetato
Citrato marcado
Isocitrato
CH 2 14 COO^2 CH 2
C 14 COO^2
CH O
CH 2 COO^2 COO^2
Apenas este produto foi formado.
Esta segunda forma de a-cetoglutarato marcado também era esperada, mas não foi formada.
❶
❷
O C COO^2
g b a g b a
CH (^2)
FIGURA Q1 Incorporação do carbono isotópico (^14 C) do grupo acetil mar- cado ao a -cetoglutarato durante o ciclo do ácido cítrico. Os átomos de car- bono do grupo acetil reagente estão representados em vermelho.
HO^ CH^2 COO^2
C
COO^2
X (^) Y Z
(a)
(c)
Ligação suscetível
CH 2 COO^2 Z
C X (^) Y Z
(b)
Z C
X (^9) Y 9 Z 9
Esta ligação não pode ser posicionada corretamente e não é atacada.
Esta ligação pode ser posicionada corretamente e é atacada.
O sítio ativo tem pontos de ligação comple- mentares.
FIGURA Q2 A natureza pró-quiral do citrato. (a) Estrutura do citrato; (b) representação esquemática do citrato: X 5 2 OH; Y 5 2 COO^2 ; Z 5 2 CH 2 COO^2. (c) Encaixe complementar correto do citrato ao sítio de liga-
ção da aconitase. Existe apenas uma maneira na qual os três grupos espe- cificados do citrato podem encaixar-se aos três pontos do sítio de ligação. Portanto, apenas um dos dois grupos 2 CH 2 COO^2 liga-se à aconitase.
Embora o ciclo do ácido cítrico gere diretamente so- mente um ATP por rodada (na conversão de succinil-CoA a succinato), as quatro etapas de oxidação do ciclo abas- tecem a cadeia respiratória, via NADH e FADH 2 , com um grande fluxo de elétrons e, assim, levam à formação de um grande número de moléculas de ATP durante a forforilação oxidativa.
Foi visto no Capítulo 14 que o rendimento energético da produção de duas moléculas de piruvato a partir de uma molécula de glicose é de 2 ATP e 2 NADH. Na fosforilação oxidativa (Capítulo 19), a passagem de dois elétrons do NADH ao O 2 impele a formação de aproximadamente 2, ATP, e a passagem de dois elétrons do FADH 2 ao O 2 rende cerca de 1,5 ATP. Essa estequiometria nos permite calcular o rendimento global em ATP da oxidação completa da gli- cose. Quando ambas as moléculas de piruvato são oxidadas a 6 CO 2 via complexo da piruvato-desidrogenase e ciclo do ácido cítrico, e os elétrons são transferidos ao O 2 via fosfori- lação oxidativa, 32 ATPs são obtidos por molécula de glico- se (Tabela 16-1). Em números redondos, isto representa a conservação de 32 3 30,5 kJ/mol 5 976 kJ/mol, ou 34% do máximo teórico de cerca de 2.840 kJ/mol disponibilizados pela oxidação completa da glicose. Esses cálculos utilizam as variações de energia livre padrão; quando corrigidos para a energia livre de fato requerida para a formação de ATP dentro das células (ver Problema Resolvido 13-2, p. 519), a eficiência calculada do processo aproxima-se de 65%.
Por que a oxidação do citrato é tão complicada? Um processo cíclico em oito etapas para a oxidação de simples grupos acetil de dois carbonos a CO 2 pode parecer desnecessariamente complicado e em discordância com o princípio biológico de economia máxima. A função do ci- clo do ácido cítrico, entretanto, não se restringe à oxidação do acetato. Essa via é o pivô do metabolismo intermediário. Produtos finais com quatro e cinco carbonos originários de muitos processos catabólicos são utilizados para alimenta- rem o ciclo e servirem como combustíveis. Oxaloacetato e a -cetoglutarato, por exemplo, são produzidos a partir de aspartato e glutamato, respectivamente, quando proteínas
TABELA 161 Estequiometria da redução de coenzimas e formação de ATP na oxidação aeróbia da glicose via glicólise, reação do complexo da piruvato-desidrogenase, ciclo do ácido cítrico e fosforilação oxidativa
Reação
Número de ATP ou coenzimas reduzidas diretamente formados
Número de ATP formados no final do processo*
Glicose ¡ glicose-6-fosfato –1 ATP^ – Frutose-6-fosfato ¡ frutose-1,6-bifosfato –1 ATP^ – 2 Gliceraldeído-3-fosfato ¡ 2 1,3-bifosfoglicerato 2 NADH^ 3 ou 5^ † 2 1,3-Bifosfoglicerato ¡ 2 3-fosfoglicerato 2 ATP^2 2 Fosfoenolpiruvato ¡ 2 piruvato 2 ATP^2 2 Piruvato ¡ 2 acetil-CoA 2 NADH^5 2 Isocitrato ¡ 2 a -cetoglutarato 2 NADH^5 2 a -Cetoglutarato ¡ 2 succinil-CoA 2 NADH^5 2 Succinil-CoA ¡ 2 succinato A ATP (ou 2 GTP)^2 2 Succinato ¡ 2 fumarato 2 FADH^2 2 Malato ¡ 2 oxaloacetato 2 NADH^5 Total 30-
CO
CO (^2)
Acetil-CoA
Citrato
Isocitrato
-Cetoglutarato
Succinil-CoA
Fumarato
Malato
Oxaloacetato
NADH
NADH
GTP (ATP)
FADH
NADH
Succinato
Ciclo do ácido cítrico a
FIGURA 1614 Produtos de uma rodada do ciclo do ácido cítrico A cada rodada do ciclo do ácido cítrico, três moléculas de NADH, uma de FADH 2 , uma de GTP (ATP) e duas de CO 2 são liberadas em reações de des- carboxilação oxidativa. Aqui, e em algumas das figuras seguintes, todas as reações do ciclo estão representadas como se elas ocorressem em apenas uma direção, lembre-se, entretanto, que a maioria das reações são reversíveis (ver Figura 16-7).
dade do ciclo do ácido cítrico. A fosfoenolpiruvato-carbo- xilase, por exemplo, é ativada pelo intermediário glicolíti- co frutose-1,6-bifosfato, que se acumula quando o ciclo do ácido cítrico processa muito lentamente o piruvato gerado pela glicólise.
A biotina da piruvato-carboxilase transporta
grupos CO (^2)
A reação da piruvato-carboxilase requer a vitamina bioti- na ( Figura 16-17 ), que é o grupo prostético da enzima. A biotina tem uma função-chave em muitas reações de car- boxilação. Ela é um transportador especializado dos gru-
pos de um carbono em sua forma mais oxidada: CO 2. (A transferência de grupos de um carbono em formas mais reduzidas é mediada por outros cofatores, particularmente tetra-hidrofolato e S -adenosilmetionina, como descrito no Capítulo 18.) Os grupos carboxil são ativados em uma rea- ção que une o CO 2 à biotina ligada à enzima com consumo de ATP. Esse CO 2 “ativado” passa a um aceptor (piruvato, nesse caso) em uma reação de carboxilação. A piruvato-carboxilase tem quatro subunidades idên- ticas, cada uma contendo uma molécula de biotina ligada covalentemente por uma ligação amida com o grupo amino « de um resíduo de Lys específico presente no sítio ativo da enzima. A carboxilação do piruvato ocorre em duas etapas
TABELA 162 Reações anapleróticas
Reação Tecido(s)/organismo(s)
Piruvato 1 HCO 3 –^1 ATP
Piruvato-carboxilase oxaloacetato 1 ADP 1 Pi Fígado, rins
Fosfoenolpiruvato 1 CO 2 1 GDP
PEP-carboxicinase oxaloacetato 1 GTP
Coração, músculo esquelético
Fosfoenolpiruvato 1 HCO 3 –^
PEP-carboxilase oxaloacetato 1 P (^) i Vegetais superiores, leveduras, bactérias
Piruvato 1 HCO 3 –^1 NAD(P)H
Enzima málica malato 1 NAD(P)^1 Amplamente distribuída em eucariotos e bactérias
Fosfoenolpiruvato (PEP) PEP-carboxilase
PEP-carboxicinase
Piruvato-carboxilase
Porfirinas, heme
Glutamato
Purinas
Arginina
Prolina
Glutamina
Pirimidinas
Aspartato Asparagina
Serina Glicina Cisteína Fenilalanina Tirosina Triptofano
Glicose Ácidos graxos, esteróis
Piruvato
Enzima málica
Piruvato
Malato a -Cetoglutarato
Succinil-CoA
Oxaloacetato
Acetil-CoA
Citrato
Ciclo do ácido cítrico
FIGURA 1616 Papel do ciclo do ácido cítrico no anabolismo. Inter- mediários do ciclo do ácido cítrico são desviados como precursores de mui-
tas vias biossintéticas. Em vermelho aparecem quatro reações anapleróticas que repõem os intermediários do ciclo esgotados (ver Tabela 16-2).
(Figura 16-17): primeiro, um grupo carboxil derivado do HCO 32 é ligado à biotina, sendo então transferido ao piru- vato para formar oxaloacetato. Essas duas etapas ocorrem em sítios ativos separados; o longo e flexível braço da bio- tina transfere os grupos carboxil ativados do primeiro sítio
ativo (em um dos monômeros do tetrâmero) ao segundo (no monômero adjacente), funcionando muito similarmen- te ao longo braço de lipoil-lisina de E 2 no complexo da PDH (Figura 16-6) e ao longo braço da porção similar a CoA da proteína transportadora de acilas envolvida na síntese de
:: HN NH
O
S
Sítio catalítico 2
O –
O P
P
O
O–
NH Lys
O
P
ATP
ADP Carboxifosfato^ P (^) i
C
Bicarbonato
Lisina biotinilada
Piruvato- -carboxilase
HO
O
H
C CH (^2)
C O
O O–
C
C CH (^2)
C O
HN NH
O
Pi SSS
O
N NH
O
S
NH
H +
O
C
O
NH
O
C
O
O
C
O
O
O –
O C O P O–
O
O H
HN N
O
S
NH
O
C O –
O
Piruvato
Oxaloacetato
HN N
O –
S
NH
O
C CH (^2)
C O –
C
O
O
NH
Enol-piruvato HN
O
S
NH
O
Rib Adenina
SS O–
NH Lys
O
ATPATP
Lisina bibiotini i iladal
Piruuvato-to- -carbboxilase
Sítio catalítico 1
Carboxibiotinil-enzima
O bicarbonato é ativado pelo ATP, formando carboxifosfato.
O carboxifosfato é transformado em CO 2.
O CO 2 reage com a biotina, formando carboxibiotina.
A biotina transporta o CO 2 de um sítio ativo A biotina é a outro. descarboxilada. O piruvato é convertido a sua forma enólica.
O enol-piruvato reage com CO 2 , formando oxaloacetato.
O oxaloacetato é liberado.
MECANISMOFIGURA 1617 O papel da biotina na reação catalisada pela piruvato-carboxilase. A biotina está ligada à enzima por uma liga- ção amida com o grupo « -amino de um resíduo de Lys, formando a enzi- ma biotinilada. A reação de carboxilação mediada pela biotina ocorre em duas fases, geralmente catalisadas em sítios ativos separados da enzima, como exemplificado pela reação da piruvato-carboxilase. Na primeira fase (etapas ➊ a ➌), o bicarbonato é convertido a CO 2 , mais ativo, sendo então utilizado para carboxilar a biotina. A biotina atua como um transportador, carregando o CO 2 de um sítio ativo ao outro, localizado em um monômero adjacente da enzima tetramérica (etapa ➍). Na segunda fase (etapas ➎ a ➐), catalisada neste segundo sítio ativo, o CO 2 reage com o piruvato para formar oxaloacetato.